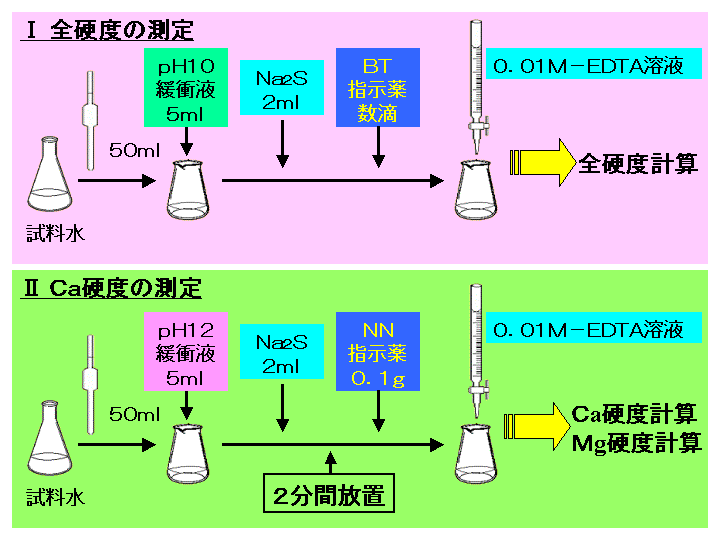
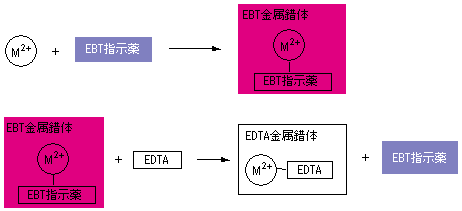
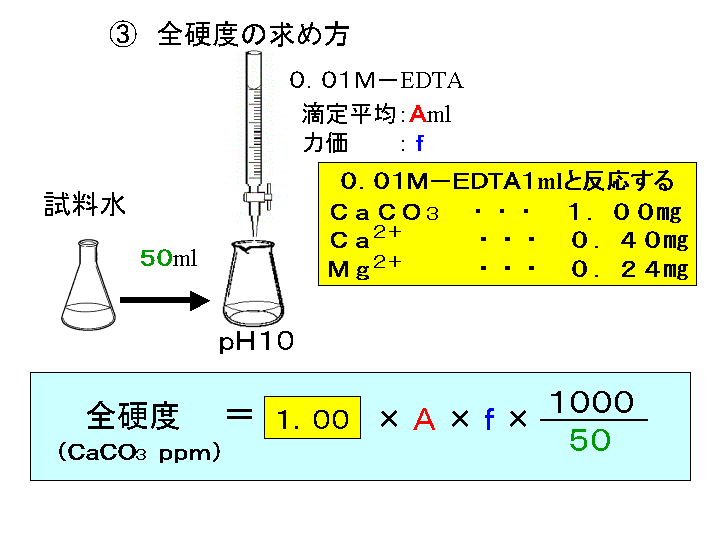
キレート滴定法を実際試料の分析に応用する場合,そ の成否を左右する最も大きな要素は,滴 定の選択性をい かにして高めるかにあるといっても過言ではないな ぜ なら,edtaを 用いるキレート滴定法は,3.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。4.キレート滴定によるCa2+とMg2+の定量 試料水にpH 10緩衝液を加え,EDTA溶液とEBT指示薬を用いてキレート滴定を 行い,試料水に含まれるCa2+とMg2+の合計量を定量する。 5.キレート滴定によるCa2+の定量

Edta 溶解度 Ph 乙二胺四乙酸 Edta Vsqhy
キレート滴定 ph12
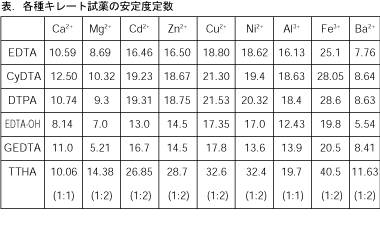
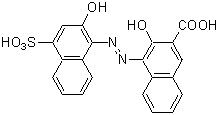
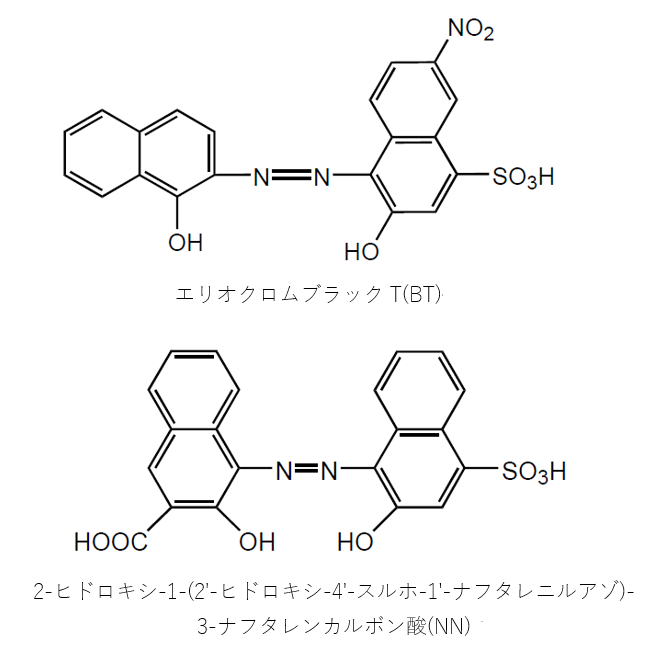
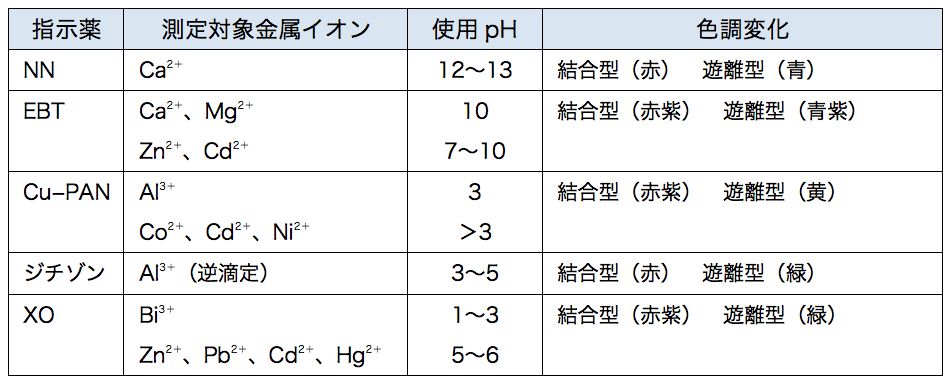
キレート滴定 ph12-性質 NNは、ほとんどの金属イオンが水酸化物として沈殿するpH12~13で、Caと錯形成することより、キレート滴定おけるCaの専用指示薬として広く使用される。 商品名であるNNは、化学名のNaphthylazoNaphthoic acidに由来するが、JIS試薬(JIS K8776)ではHSNNの略名でとなる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋
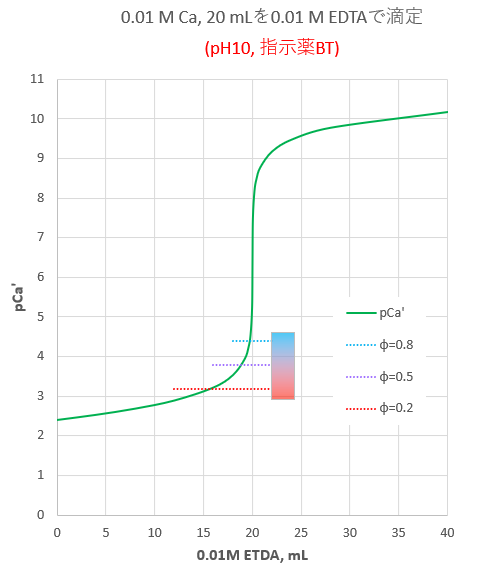
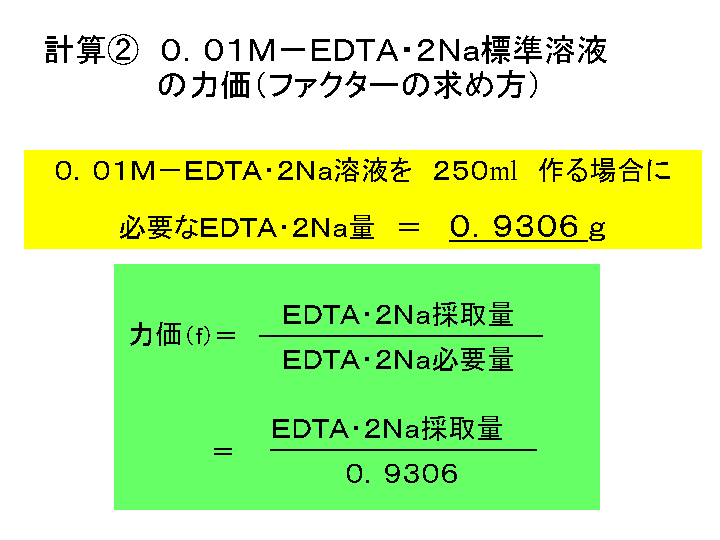
Iso 」などに基づいて、edta 2na 溶液でキレート滴定を行います。水酸化カリウム溶 液で検体をph12~13に調整しマグネシウムの共沈を防ぐことで、カルシウムのみの硬度が測定 可能です。 本体 : 電位差自動滴定装置 (プリアンプリファイア pta)最新 キレート滴定 ph 理由 3685キレート滴定 ph 理由 PH10の溶液中ではカルシウムもマグネシウムもイオンの状態(Ca 2 とMg 2 )で存在しますので,両方ともキレートを生成します(全硬度).pH12ではマグネシウムは水酸化物Mg(OH) 2 になり,キレートを生成PH12緩衝溶液を駒込ピペットで5ml加える。 3) Na 2 S溶液を駒込ピペットで2ml加え、約2分間放置する。 4) NN指示薬を約0.1g加える。 5) ビュレットの0.01M-EDTA標準溶液で滴定を行う。
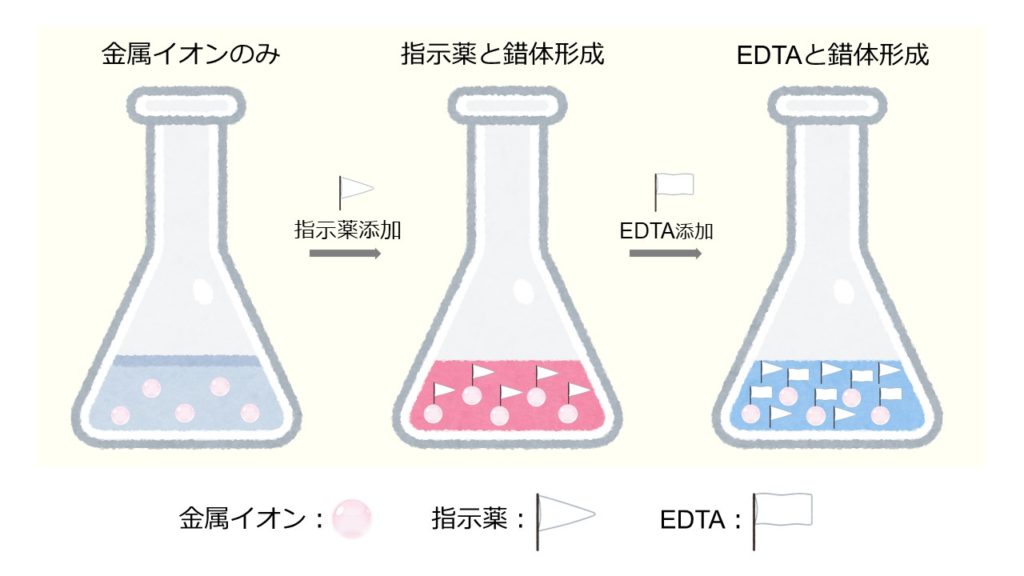
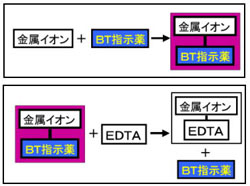
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63138 第7章 沈殿の生成と溶解,沈殿滴定と反応 解 Mg(OH)2が沈殿するための条件は Ksp<Mg 2+OH−2 Mg2+=01 (mol/L),K sp, Mg(OH)2 =1×10−10より 1×10−10<01OH−2 OH−> 1×10−10 01 =3×10−6 pOH<55 ∴pH>85 D 硫化物の生成PH12緩衝液(NaOH50gを純水に溶解し1リットルにする) pH10緩衝液(塩化アンモニウム(NH 4 Cl)70g と 濃アンモニア水570gを純水を加え1リットルにする) 器具
PH計・導電率計・標準液 :「ph12」の検索結果 pH計・導電率計・標準液とは、液体などのpH濃度や導電率を測定するための器具、そして標準液はそれぞれを測定する前に器具の校正を行うために使用するものです。 pH計、誘電率計ともに使用する環境は水K 0102 :16 目次 (6) ページマグネシウム(mg) 7 511 キレート滴定法 8 512 フレーム原子吸光法 9 513 icp発光分光分析法 キレート滴定法 2 502 フレーム原子吸光法 5 503 icp発光分光分析XIII6 キレート滴定法各論 局方で用いられているキレート滴定治の例(教科書 p168 、表 5・3・3): %NaOH 1mL (→ pH12 ) 10 %KCN 数滴 10 %NH 2OH ・HCl 数滴( NN の酸化防止) 001mol/L EDTA




1999 号 アミノ酸塩の製造方法 Astamuse



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量
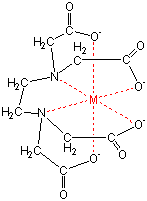
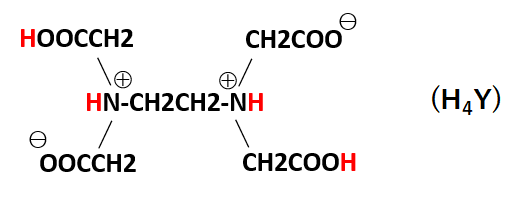
Q18 キレート滴定法で行う硬度分析. q17 電解水をよう素滴定法で分析する原理. q10 塩化亜鉛水溶液に塩酸を少量加え,亜鉛板と銅板を接触させて入れて高温を保つと,銅に亜鉛が析出する理由.滴定用キレート試薬として、ドータイト2na(edta2ナトリウム 塩)、その他ドータイト金属指示薬、キレート滴定用補助試薬など、 キレート滴定に必要な試薬類は全部とりそろえているので、ご利 用いただきたい。 nc h2ch2 n ch 2cooh hoocch2 ch2cooh hooc 2 on o n m ch2 ch2キレート滴定 1、目的 EDTAを用いるキレート滴定により、EDTAの濃度を求める。さらにそれを利用して濃度未知のCaCO3溶液の濃度を求める。 2、装置・器具・試薬 250mlメスフラスコ,250ml試薬びん,100mlメスシリンダー,10mlホールピペット,2ml駒込ピペット,0mlコニカルビーカー3個,ビュレット



1




21 号 軟水化装置 Astamuse
Offmarket See photos and descriptions of 166 W 18th St #PH12, New York, NY This New York, New York Condo House is 4bed, 5bath, estimated for undefined MLS# Casas de venta en New York, NYキレート滴定 ph10 理由 キレート滴定 ph10 理由 The chemical times 06no2(通巻0号)17 化学分析における基礎技術の重要性(5) 25イオン交換滴定法 硫酸ナトリウムなどの中性の塩 類の純度試験では、イ従って、キレート滴定に使用する場合、溶解後直ちに滴定鉛イオン(Pb2)の定量法としては、一般にキレート滴定が広く活用されています。鉛イオンを直 接滴定できるpH 領域はpH35~10(安定度定数=17)となっています。しかしアルカリ性領 域ではPb(OH)キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化



水の硬度測定



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量
キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化物となってEDTAと反応しなくなるので、このpH領域で作用するNN指示薬を用いて Ca 2+ のみを定量することができる。キレート滴定による濃度測定 小寺真暉 永山貴大 吉井崇人 鶴崎さくら 指導者:岩本昌子 pH12緩衝液(5% naoh)(米山薬品工業), ビュレット ,ビュレット台, メスフラスコ(250ml、100ml) ,亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多



水の硬度測定 キレート滴定



水の硬度測定 キレート滴定
PH12 以上では オレンジ色になる。Ca2+,Mg2+ などの金属イオンを含む溶洷中に加えるとキレート 化合物を生成し、赤紫色を呈する。 NN指示薬 pH12 ~13 で青色を呈し、キレートを作る ことにより赤色へ変化する。 硬度化学実験(キレート滴定)での考察の書き方が分かりません。 Mg2イオンはpH11付近から水酸化物の沈殿を生じ始め、pH12以上 環境Q&A 炭酸カルシウム(CaCO3)換算の意味 炭酸カルシウム(CaCO3)換算の意味 登録日: 02年12月02日 最終回答日:02年12月06日 水・土壌キレート滴定法による Chelate Titration Method 測定範囲 各 CaCO3 5~500 mg/L程度 全硬度 カルシウム硬度 型式:WADTH 型式:WADCa 測り方 ① ② ③ ④ *終点とは 付属の計量カップに検水を10mL採ります。 R1試薬(pH緩衝液)、R2試薬(指示薬)を加え、撹拌します。




比色試薬 金属指示薬 Bt 同仁化学研究所




キレート滴定14
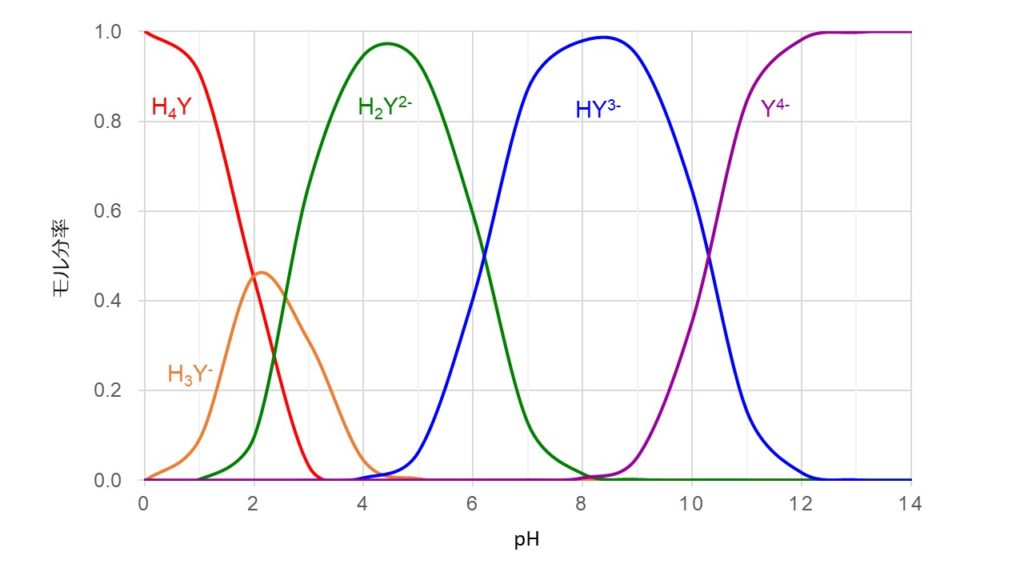
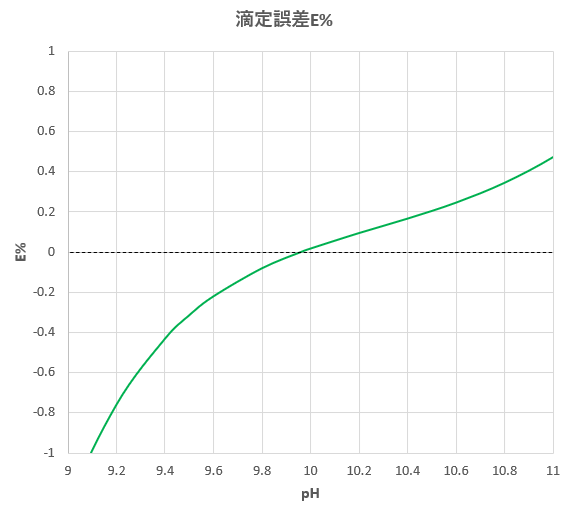
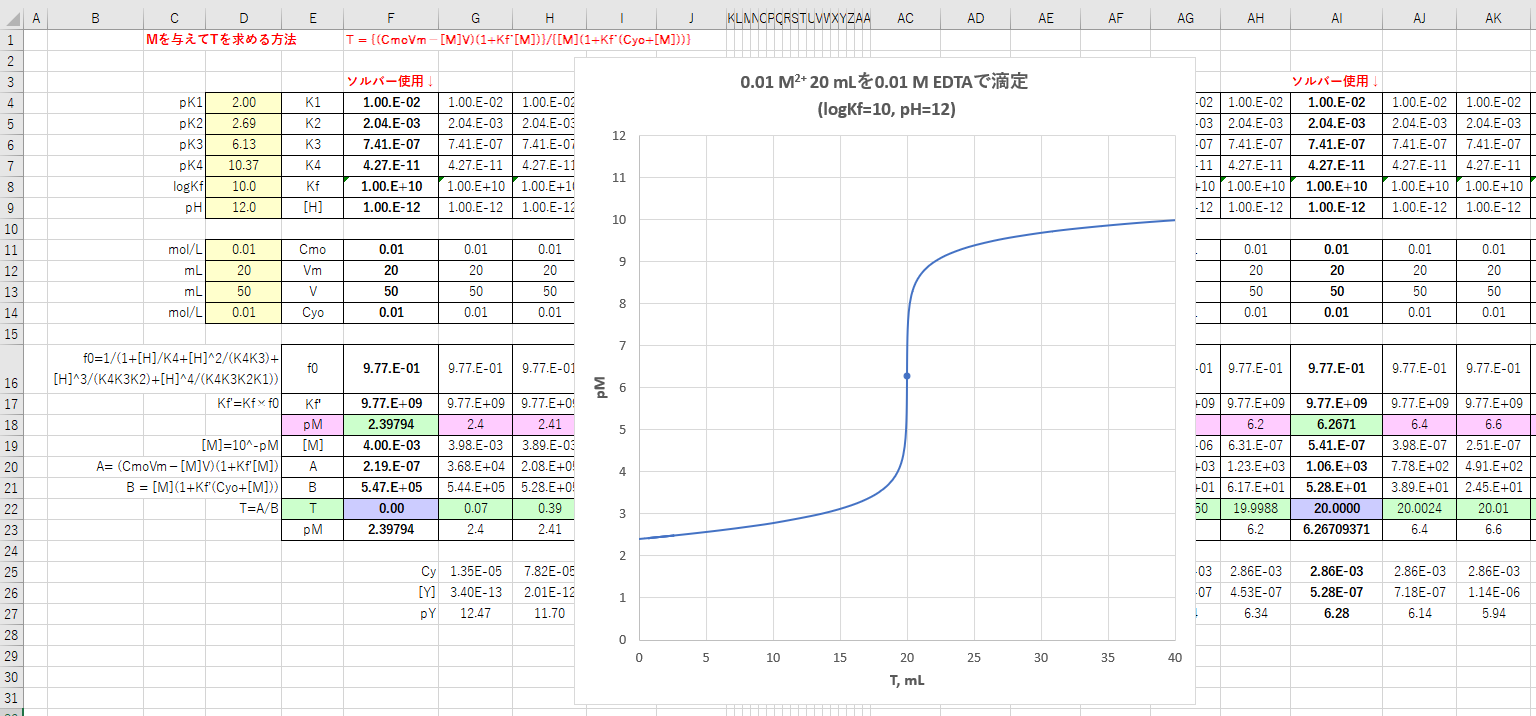
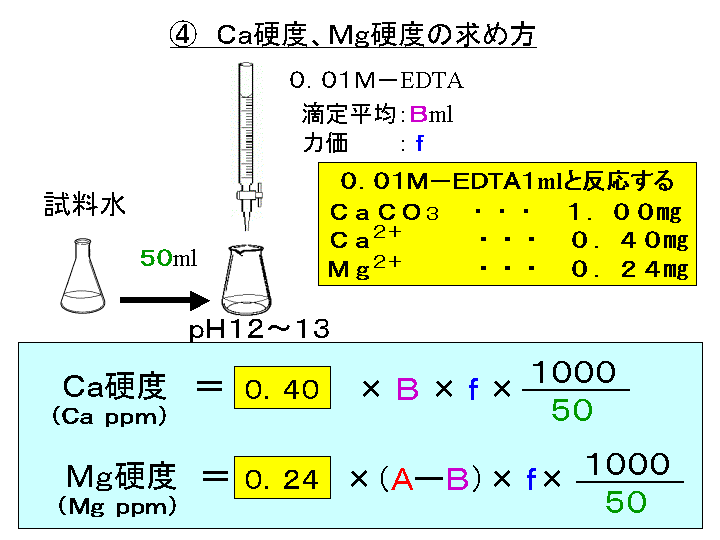
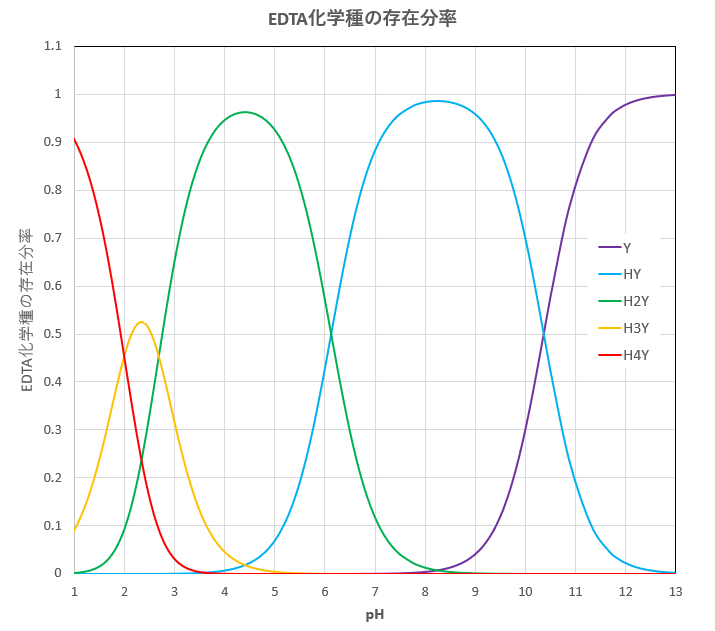
キレート滴定 に示します。図1から明らかなように、たとえば、Y 4の分率 f 0 はpH10では030、pH12では098キレート滴定はキレート試薬を用いて金属イオンを定量する滴定法であり、錯滴定とも呼ばれる。 これは金属キレート化合物(金属多座配位子錯体)が安定であることを利用した滴定法である。 次に、試料に水酸化カリウムを加えpH1213 として滴定するキレート滴定によるカルシウム硬度の測定 ① ホールピペットで検水を50ml正確に測りとり、コニカルビーカー(0ml)に ④ NN指示薬約01gを(1)に加える。これは、pH12~13で錯体を作ると赤紫色



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com



水の分析
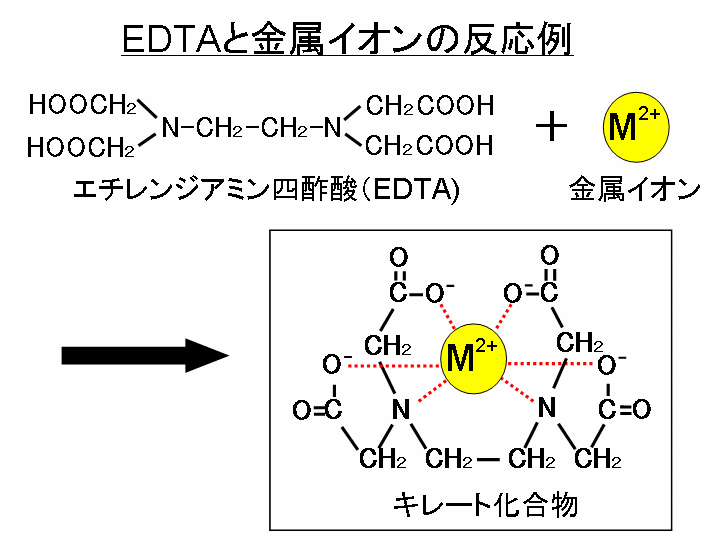
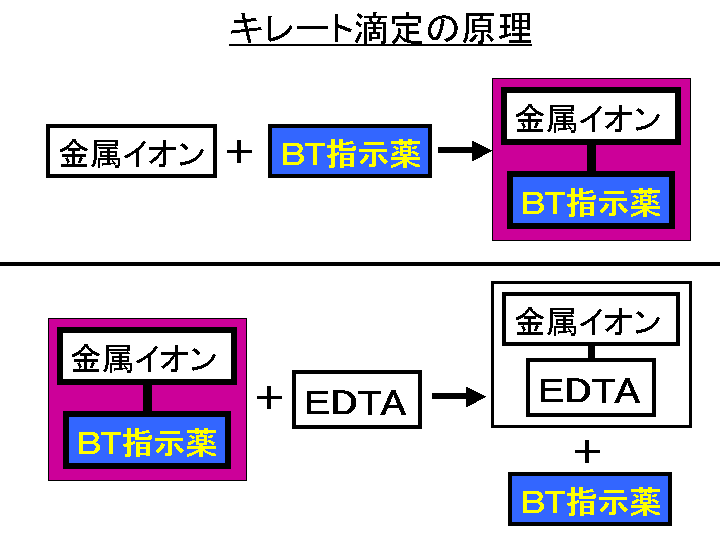
質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法社団法人 日本農芸化学会 双分極性白金電極を使用してキレート滴定を行ない,カルシウム,マグネシウム,カドミウムを定量した金属イオンの定量を1Mトリエタノールアミン1ml含有の01Mアンモニア塩化アンモニウム緩衝液(pH 11)中で08Vの定電圧をかけて行なった添加したトリエタノールアミンが金属イオンの滴定法をキレート滴定法と呼ぶのもそのた めです 3 滴定試薬としての応用(キ レート滴定法) 3・1 キレート滴定法の原理 ふたたび反応式(iii)に ついて考えてみましょう あ る金属イオン(m)の 水溶液にedta溶 液(y)を 滴




比色試薬 金属指示薬 Nn 同仁化学研究所



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com
キレート滴定(キレートてきてい、chelatometric titration )とは、錯滴定の一種で、錯形成試薬としてキレート試薬と呼ばれる多座配位子を用いるもの。 この容量分析法は金属 イオンの迅速で簡単な定量法の1つとして広く用いられている。 主なキレート試薬としてEDTA(エチレンジアミン四酢酸º"' '¨>/( 9 / _7 K ó ² x( Ø _ P M ï 8 4Ä Ö M m A Æ 9 / _7 K E @ x ¦ > 75 D S u _ _ ó ² ^ 8 ° @ E ²0 @ 6 r3回の滴定の平均をとる。 ≪Ca2≫ ①試料水を硬度に応じ、25 mL、50 mL、100 mLのいずれかを選択し、ホールピペットを用いてコニカルビーカーにとる。 ②6 mL/L KOH溶液4 mL(pH=12ではマグネシウムは水酸化物Mg(OH)2になり、キレートを生成しない。



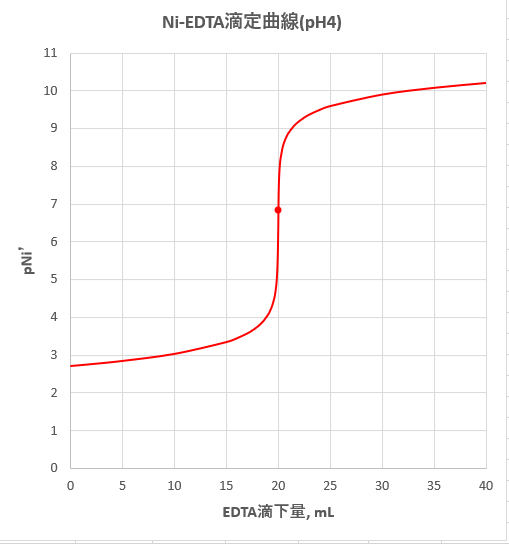
カルシウムのedta滴定 3 金属指示薬の選定 滴定曲線 溶解度などーエクセルを用いて



比色試薬 金属指示薬 Bt 同仁化学研究所
の滴定の際,pHを125程 度とした場合に,指 示薬が ピンク色を示さなければ,1回 目の滴定のみで滴定は完 了したのであるから,2回 目の滴定を行なう必要はな いま た,カ ルシウムとマグネシウムの合量がわかって いて,1回 目の滴定で測定されたカルシウムの量鉛イオンを直 接滴定できるpH 領域はpH35~10(安定度定数=17)となっています。しかしアルカリ性領 域ではPb(OH)キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化4 操作(6) (5)の試験を行った溶液にさらに1 mol L–1 水酸化ナトリウム水溶液を3 mL 加えた。 Ca2, Mg2 白色沈殿が生じた。水酸化物が生成したものと考えられる。 Al3, Zn2 沈殿または白濁が溶け,無色透明な溶液に変化した。Al3溶液ではテトラヒドロキ ソアルミン酸イオンAl(OH)4



2




キレート滴定14



キレート滴定についてです 現在高校生で 個人的な理由で Yahoo 知恵袋



キレート滴定14



2




Edta 溶解度 Ph 乙二胺四乙酸 Edta Vsqhy



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



水の硬度測定



1



2



2



滴定 滴定曲線 溶解度などーエクセルを用いて



Column



キリヤ Q A




Edta 溶解度 Ph 乙二胺四乙酸 Edta Vsqhy




最新 キレート滴定 Ph 理由 3685 キレート滴定 Ph 理由 Blogjpmbahe0jrd



水の硬度測定 キレート滴定




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



キリヤ Q A



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋




1999 号 アミノ酸塩の製造方法 Astamuse




21 号 軟水化装置 Astamuse



水の硬度測定 キレート滴定




比色試薬 金属指示薬 Pan 同仁化学研究所




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



滴定曲線 滴定曲線 溶解度などーエクセルを用いて



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて




水の硬度測定 キレート滴定




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




キレート滴定 Yakugaku Lab



比色試薬 金属指示薬 Nn 同仁化学研究所



2




キレート滴定14



47 2 カルセインブルー Calcein Blue 8 N N Bis Carboxymethyl Aminomethyl 4 Methylumbelliferone 347 詳細情報 試薬 富士フイルム和光純薬



質問箱




Edta 溶解度 Ph 乙二胺四乙酸 Edta Vsqhy
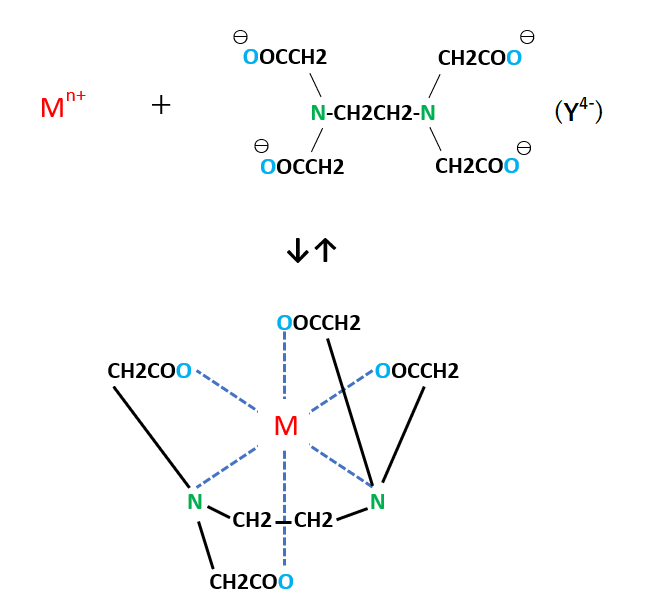



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com



3回生実験のこと 容量分析の初歩ex



1



2
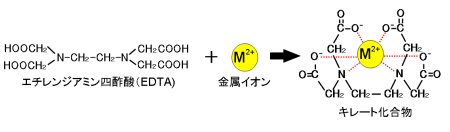



水の硬度測定 キレート滴定



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



水の硬度測定 キレート滴定



2jddebf5jtufqm



水の硬度測定




比色試薬 金属指示薬 Bt 同仁化学研究所



Ocw Kyoto U Ac Jp
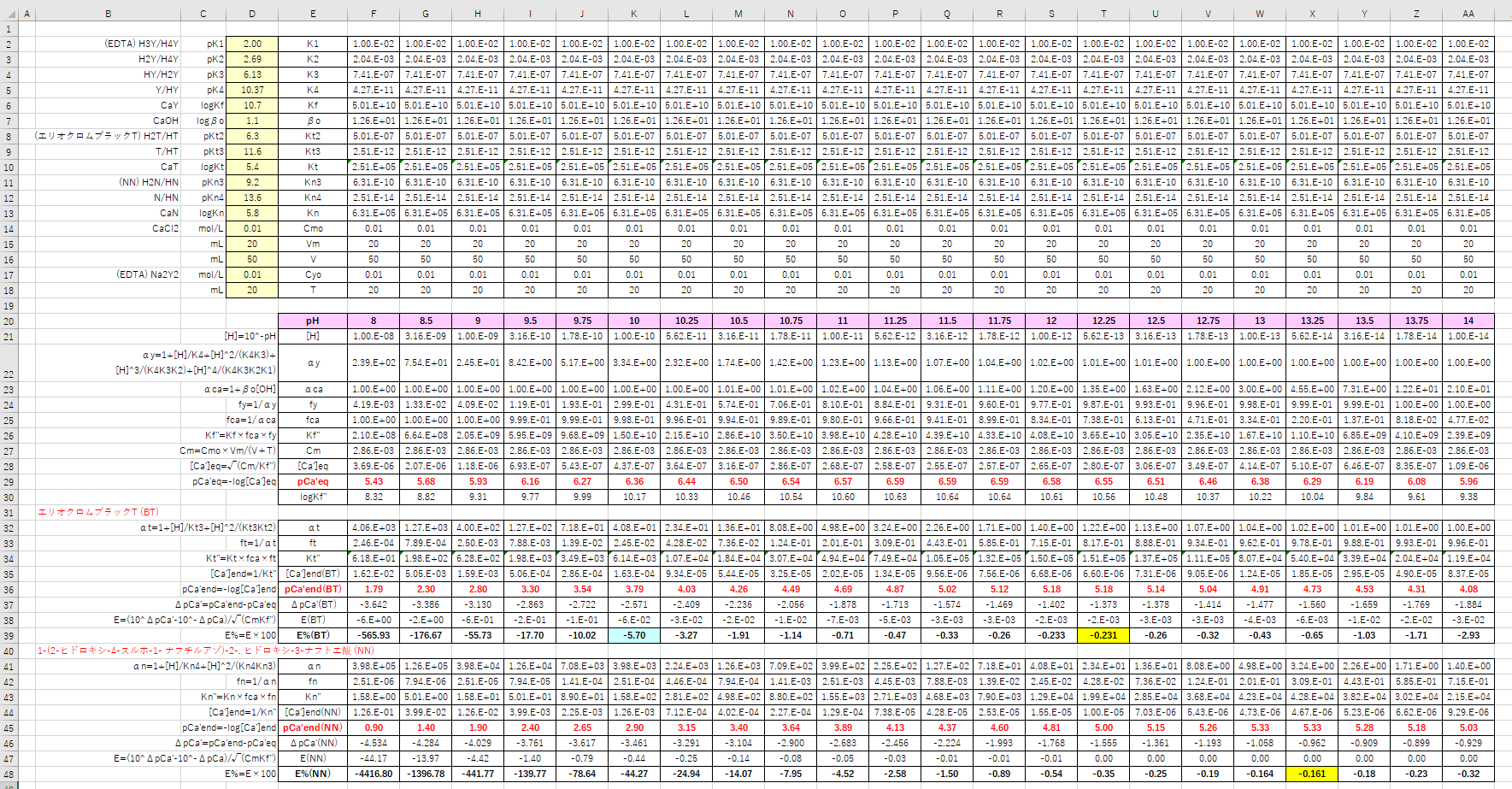



カルシウムのedta滴定 3 金属指示薬の選定 滴定曲線 溶解度などーエクセルを用いて



年06月 滴定曲線 溶解度などーエクセルを用いて
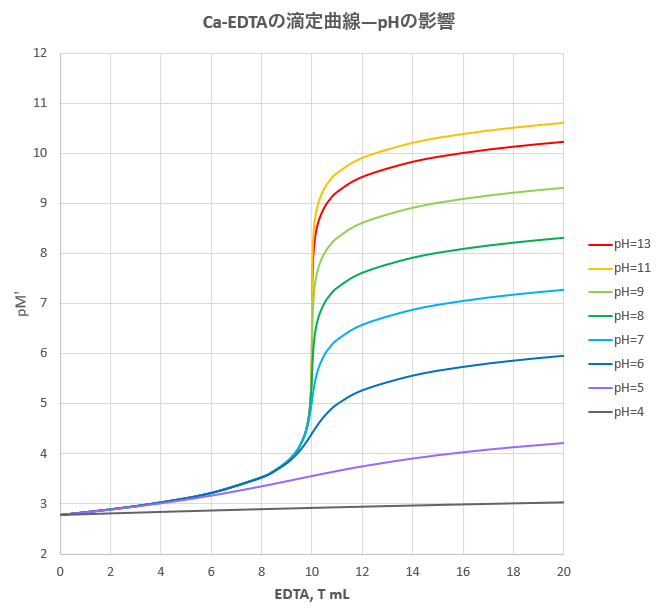



年05月 滴定曲線 溶解度などーエクセルを用いて



水の硬度測定




1999 号 アミノ酸塩の製造方法 Astamuse




キレート滴定14



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



2



カルシウムのedta滴定 3 金属指示薬の選定 滴定曲線 溶解度などーエクセルを用いて




水の硬度測定 キレート滴定



2



2



2




21 号 軟水化装置 Astamuse




比色試薬 金属指示薬 Pan 同仁化学研究所



水の硬度測定 キレート滴定




Edta 溶解度 Ph 乙二胺四乙酸 Edta Vsqhy




水の硬度測定




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



2



キレート滴定 Yakugaku Lab




水の硬度測定 キレート滴定



キレート わかりやすく




キレート滴定14




02 号 赤外線を用いた塩の水分 粒径およびマグネシウム濃度の同時測定方法および測定の補正方法 Astamuse



水の硬度測定 キレート滴定



キレート滴定 Yakugaku Lab



年11月発行 カルシウム塩のキレート滴定について




キレート滴定14



2
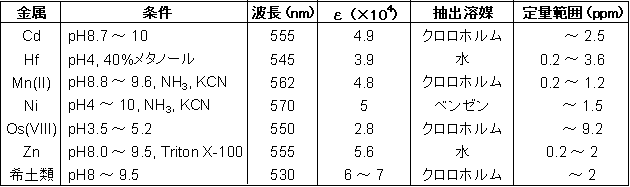



比色試薬 金属指示薬 Pan 同仁化学研究所




薬剤師国家試験 領域別既出問題集 メルカリ



キリヤ Q A



2



2



化学の質問です Nn指示薬ではどの原子と金属が配位結合するのでしょうか Yahoo 知恵袋



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて




Edta 溶解度 Ph 乙二胺四乙酸 Edta Vsqhy



2



0 件のコメント:
コメントを投稿